BF3 লুইস এসিড কেন?
লুইস এসিডের সংজ্ঞানুসারে যে সকল যৌগ একজোড়া ইলেক্ট্রন গ্রহন করতে পারে তাদের লুইস এসিড বলে। বোরন ট্রাইফ্লোরাইড অণুতে বোরন পরমাণুর বহিস্তরে ছয়টি ইলেকট্রন অর্থাৎ অষ্টকের চেয়ে দুইটি ইলেকট্রন কম থাকে এ জন্য বোরন ট্রাই ফ্লোরাইড এক জোড়া ইলেক্ট্রন গ্রহন করতে পারে এবং লুইস এসিড হিসেবে কাজ করে।
যেমন, অ্যামোনিয়া অণুর নাইট্রোজেন পরমাণুতে একজোড়া মুক্ত ইলেকট্রন থাকে। অপরদিকে, বোরন ট্রাইফ্লোরাইড অণুতে বোরন পরমাণুর বহিস্তরে ছয়টি ইলেকট্রন অর্থাৎ অষ্টকের চেয়ে দুইটি ইলেকট্রন কম থাকায় অ্যামোনিয়া ও বোরণ ট্রাইফ্লোরাইডকে পরস্পরের সান্নিধ্যে আনলে নাইট্রোজেন একজোড়া ইলেকট্রন সরবরাহ করে যা নাইট্রোজেন ও বোরণ পরমাণুর মধ্যে শেয়ার হয়ে উভয় পরমাণুর মধ্যে সন্নিবেশ বন্ধন গঠন করে।
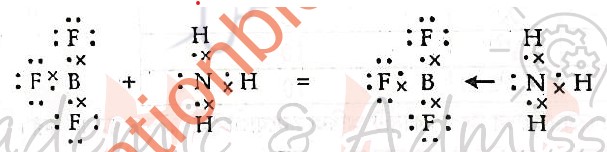
এসিড সংক্রান্ত অন্যান্য প্রশ্ন-